Trong nền sản xuất công nghiệp nhất là ngành công nghiệp hóa chất, luyện kim và quá trình sinh hoạt của con người phát thải một lượng lớn nguồn SO2 vào môi trường. Nguồn gốc phát sinh chủ yếu của SO2 thường có nguồn gốc từ quá trình nung, lò hơi, nhiệt điện, quá trình đốt nhiên liệu, dầu hoặc khí đốt. Một lượng khí SO2 đáng kể thất thoát ra bên ngoài trở thành mối nguy hại đối với cả thế giới không chỉ riêng Việt Nam. Được biết mỗi năm có khoảng 60 triệu tấn/năm SO2 thải ra môi trường. Vì thế cần tìm ra biện pháp xử lý khí thải SO2 nhằm giảm tải quá trình ô nhiễm môi trường.

1. Đặc tính và tác hại của khí thải chứa SO2
Đặc tính:
- Khí SO2 không màu, khối lượng phân tử nặng hơn nước, không cháy, dễ hòa tan trong nước, mùi hăng và vị cay.
- Khí SO2 thường có nhiệt độ nóng chảy ở -75 độ C và có nhiệt độ sôi -10 độ C.
- Khí SO2 dễ dàng phản ứng với oxy tạo thành SO3 trong bầu khí quyển và hòa tan trong nước tạo thành axit H2SO4.
Tác hại của khí SO2:
- Khí SO2 là tác nhân gây ô nhiễm bầu khí quyển, gây ra các hiện tượng biến đổi khí hậu như mưa axit, hoặc làm mòn các công trình xây dựng, ngăn cản sự phát triển của thực vật.
- Đối với con người, khí SO2 gây khó thở, nóng rát vùng mũi, cổ họng, gây ra các bệnh về đường hô hấp, viêm phổi, viêm mắt. Khi SO2 tiếp xúc với nước sẽ hình thành nên axit H2SO4 đi vào phổi và hệ thống bạch huyết. SO2 nếu dự trữ nhiều trong máu sẽ hình thành nên các phản ứng hóa học gây rối loạn lượng đường và protein, thiếu hụt vitamin, ngăn cản khả năng vận chuyển oxy của hồng cầu.
2. Các phương pháp xử lý khí thải SO2
2.1. Hấp thụ SO2 bằng nước
Nước là tài nguyên rất dễ kiếm, rẻ tiền và mang lại nhiều hiệu quả xử lý khác nhau nên chúng ta có thể áp dụng để xử lý khí thải SO2. Dưới đây là giai đoạn xử lý:
- Giai đoạn 1: Phun nước vào dòng khí thải có tiếp xúc qua lớp vật liệu đệm tưới nước để dễ dàng hấp thụ khí SO2
- Giai đoạn 2: Tiến hành đưa khí SO2 ra ngoài môi trường để thu hồi SO2
Ngoài ra để hấp thụ khí SO2 hoàn toàn phải sử dụng nguồn nước có nhiệt độ cao.
Điều kiện để xử lý khí thải SO2 chỉ được áp dụng phụ thuộc vào các điều kiện sau:
- Nồng độ SO2 trong khí thải tương đối cao
- Có nguồn nước cấp nhiệt với giá rẻ
- Có sẵn nguồn cấp lạnh
- Có thể xả nước có tính axit ra sông ngòi
2.2. Xử lý SO2 bằng dung dịch sữa vôi
- Sữa vôi vốn dĩ là dung dịch bão hòa của vôi Ca(OH)2 với nước. Khi khí SO2 tiếp xúc sẽ được dung dịch này hấp thụ hoàn toàn, qua phản ứng:
Ca(OH)2 + SO2 -> CaSO3 + H2O
- Tiếp theo sunfit canxi bị oxy hóa thành sunfat canxi và lắng xuống đáy
2CaSO3 + O2 -> 2CaSO4
Trong đó, sữa vôi được hòa trộn và phun vào tháp sấy khô. Hạt dung dịch NaOH khô dần và chúng bắt đầu hấp thu SO2 và dẫn về thiết bị thu bụi sau buồng phun.
2.3. Sử dụng đá vôi CaCO3 hoặc vôi nung CaO
- Đá vôi hoặc vôi nung là những nguyên liệu đơn giản và dễ tìm vì thế chúng được áp dụng rộng rãi và phổ biến trong công nghiệp. Ngoài ra với chi phí đầu tư thấp, không cần đến vật liệu chống axit, ít tốn diện tích xây dựng, hiệu quả xử lý cao và có sẵn trong môi trường tự nhiên nhiều nên đá vôi là giải pháp tối ưu trong hệ thống xử lý khí thải SO2.
- Khi đồng thời hấp thụ nhiều khí, vận tốc hấp thụ mỗi khí bị giảm sút. Khi hấp thụ hóa học trong tháp chảy màng hay tháp đệm xuất hiện hiện tượng đối lưu trên bề mặt giúp phân chia thành dòng đối lưu cưỡng bức thúc đẩy quá trình truyền khối.
Quá trình hấp thụ diễn ra trong nhiều dạng tháp khác nhau như tháp đệm, tháp chảy màng, tháp đĩa, tháp phun, tháp sủi bọt và tháp tầng sôi. Trong đó các tháp này phải có hiệu quả xử lý xuyên qua, trở lực thấp, với kết cấu đơn giản và quá trình vận hành đơn giản, khối lượng nhỏ, hạn chế quá trình tắc nghẽn.
- Đối với tháp đệm: phải có năng suất nhỏ, có diễn ra quá trình ăn mòn với tỷ lệ khí lớn, khí không chứa bụi và quá trình hấp thụ không tạo ra cặn lắng
- Đối với tháp đĩa: cho phép vận tốc lớn đi qua và giảm đường kính tháp, năng suất lớn, lưu lượng lỏng nhỏ và không có môi trường ăn mòn
Tháp hấp thụ khí SO2 với cơ cấu phun chất lỏng bằng phương pháp cơ học bằng tháp phun. Tháp này chỉ hoạt động khi có trở lực bé và chứa hạt rắn. Vì lớp đệm của chúng di chuyển linh động theo nhiều hướng khác nhau nên chúng được ứng dụng cho nhiều lĩnh vực xử lý khác nhau, trong đó có SO2.
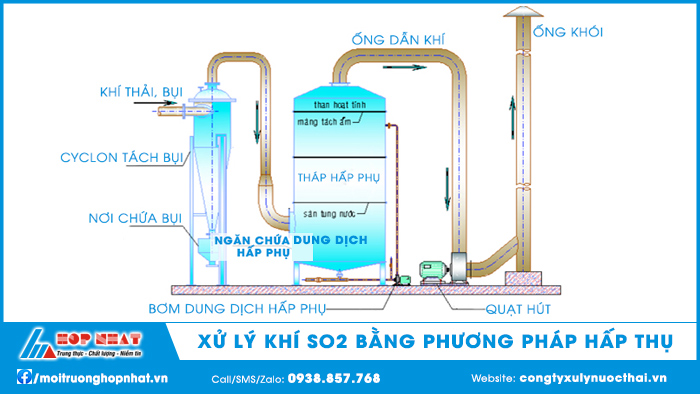
2.4. Hấp thụ SO2 bằng dung dịch NaOH
Khi sử dụng NaOH khắc phục được nhược điểm của vôi đó là ít xảy ra quá trình nghẹt hệ thống phun và chỉ hấp thu SO2. Đồng thời, với phản ứng phụ với CO2 chỉ có một phần cacbonat natri sẽ phản ứng trực tiếp với SO2 tạo thành sunfit và bisunfit natri
2.5. Hấp thụ SO2 bằng magiê oxit (MgO)
Khi Magiê oxit phản ứng với SO2 sẽ tạo thành tinh thể sunfit magie. Mà sunfit magie trong nước không cao nên chúng trở thành cặn lắng. Để quá trình hấp thụ SO2 diễn ra thuận lợi hơn, tiến hành oxit magie thành sunfat magie.
MgO + SO2 -> MgSO3
MgO + H2O -> Mg(OH)2
MgSO3 + H2O + SO2 -> Mg(HSO3)2
Mg(OH)2 + Mg(HSO3)2 -> 2MgSO3 + 2H2O
Theo đó, quá trình tái sinh magie diễn ra ở nhiệt độ 900 độ C bằng cách nung có thêm nguyên liệu là than cốc. Lúc này, khí SO2 thoát ra ngoài. Người ta tiến hành làm nguội khí, xử lý bụi rồi đem đi sản xuất thành axit sunfuric.
2.6. Hấp thụ khí SO2 bằng các chất hữu cơ
Đây là phương pháp xử lý khí thải SO2 được ứng dụng nhiều trong ngành công nghiệp luyện kim màu. Một số chất hữu cơ để hấp thụ SO2 được ứng dụng phổ biến là các amin thơm (anilin, toluđin, xyliđin và đimety-anilin).
Quá trình hấp thụ bằng các chất hữu cơ diến ra trong 2 giai đoạn cơ bản dưới đây:
- Giai đoạn 1: Quá trình sunfidin
- Giai đoạn 2: Quá trình khử SO2 bằng dimetylanilin

Nếu có bất kỳ nhu cầu nào về xử lý khí thải SO2, quý doanh nghiệp có thể liên hệ trực tiếp với công ty môi trường Hợp Nhất theo Hotline 0938 089 368!


